Калий температура кипения. Оксид калия: формула, взаимодействие
Калий - щелочной металл, который достаточно широко распространен на Земле. Соединения калия с давних времен знакомы людям. Элемент был открыт в 1807 году и был изначально назван потассием. Однако, название не прижилось и чуть позже элемент был назван калием.
С давних времен люди получали поташ (карбонат калия) из продуктов горения. Его использовали как моющее средство, чуть позже его начали применять для производства различных сельскохозяйственных удобрений, для изготовления стекла и других целей. На сегодняшний день поташ даже является официально зарегистрированной пищевой добавкой.
Характеристика калия
Физические свойства

Элемент имеет бледно-серебристый цвет. На только что образовавшейся поверхности возникает характерный блеск. Калий - легкий металл. Легко плавится. Его можно растворить в ртути, в результате этого процесса образуются амальгамы. Горит красновато-фиолетовым пламенем.
Химические свойства

Калий является металлом и обладает всеми соответствующими свойствами. Также элемент относится к группе щелочных. Этим и объясняется его повышенная химическая активность. Калий, реагируя с другими веществами, отдает электроны, является сильным восстановителем.
- Вступает в бурную реакцию с кислородом, образуя супероксид калия.
- При нагревании реагирует с водородом.
- Хорошо реагирует со всеми неметаллическими элементами, образуя при этом нитриды, фосфиды, сульфиды и другие соединения.
- Вступает в реакцию со многими сложными веществами: солями, оксидами, а также с водой. Реакция с водой протекает очень бурно, со взрывом.

Соединения калия достаточно распространены в природе. В чистом виде калий встретить нельзя. Причина этому - его повышенная химическая активность.
Где же в природе можно найти калий?
- Во-первых, калий в достаточно больших количествах содержится в коре Земли. Его содержание оценивается примерно в 2,4%. Калий является важной составляющей почвы, горных пород.
- Во-вторых, большие залежи солей калия зафиксированы на местах испарения древних морей.
- Также существенное количество калия содержат в себе воды Мирового океана. В водах Мирового океана концентрация калия составляет примерно 0,06%. В отдельных водоемах (например, Мертвое море), концентрация калия может быть и 1,5%. Такая повышенная концентрация делает экономически выгодной добычу калия. Так, в Иордании стоит завод по добыче калия из вод Мертвого моря.
Области применения калия

Сфера использования калия существенно уже по сравнению с тем же натрием. Это обусловлено тем, что калий обладает большей химической активностью. Кроме того, калий является более дорогим металлом. Тем не менее, калий все же используется в различных отраслях промышленности.
- Активней всего калий используют в химической промышленности для производства удобрений. Калий является важным элементом для растений. Довольно часто растения испытывают нехватку калия, что приводит к тому, что растение не может использовать весь свой потенциал роста. Растение становится ослабленным, медленнее растет, стебель слабеет, листья желтеют и опадают, семена становятся менее всхожими. Дефицит калия в таких случаях восполняют с помощью удобрений. Именно калийные удобрения являются основной продукцией, для которой используется калий. Самым распространенным калийным удобрением является хлорид калия (KCl).
- Кроме того, элемент и его соединения используют в машиностроении. Гидроксид калия - важнейший элемент для изготовления аккумуляторов.
- Соединения калия также используются в пищевой промышленности. Яркий пример - нитрат калия. Вещество является пищевой добавкой. Используется в качестве консерванта.
В этой статье будет дана характеристика калия с точки зрения физики и химии. Первая из этих наук изучает механические и внешние свойства веществ. А вторая - их взаимодействие друг с другом - это химия. Калий - девятнадцатый по счету элемент в таблице Менделеева. Он принадлежит к В этой статье будет рассмотрена и электронная формула калия, и его поведение с другими веществами и т. д. Это один из наиболее активных металлов. Наука, которая занимается изучением этого и других элементов - химия. 8 класс предусматривает изучение и их свойств. Поэтому данная статья будет полезна школьникам. Итак, начнем.
Характеристика калия с точки зрения физики
Это простое вещество, которое при нормальных условиях находится в твердом агрегатном состоянии. Температура плавления составляет шестьдесят три градуса по шкале Цельсия. Закипает же данный металл, когда температура достигает семисот шестидесяти одного градуса по Цельсию. Рассматриваемое вещество обладает серебристо-белой окраской. Имеет металлический блеск.
Плотность калия составляет восемьдесят шесть сотых грамма на сантиметр кубический. Это очень легкий металл. Формула калия очень проста - он не формирует молекул. Данное вещество состоит из атомов, которые расположены близко друг к другу и имеют кристаллическую решетку. Атомная масса калия равняется тридцати девяти граммам на моль. Твердость его очень низкая - его можно легко порезать ножом, как сыр.
Калий и химия
Начнем с того, что калий - химический элемент, который обладает очень высокой химической активностью. Даже хранить его на открытом воздухе нельзя, так как он моментально начинает реагировать с окружающими его веществами. Калий - химический элемент, который относится к первой группе и четвертому периоду таблицы Менделеева. Он обладает всеми свойствами, которые характерны для металлов.
Взаимодействие с простыми веществами
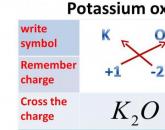
К ним относятся: кислород, азот, сера, фосфор, галогены (йод, фтор, хлор, бром). По порядку рассмотрим взаимодействие калия с каждым из них. Взаимодействие с кислородом называется окислением. В течение данной химической реакции расходуется калий и оксиген в молярном соотношении четыре части к одной, в результате чего образуется оксид рассматриваемого металла в количестве двух частей. Данное взаимодействие можно выразить при помощи следующего уравнения реакции: 4К + О2 = 2К2О. При горении калия можно наблюдать

Поэтому данная реакция считается качественной на определение калия. Реакции с галогенами называются в соответствии с названиями этих химических элементов: это йодирование, фторирование, хлорирование, бромирование. Данные взаимодействия можно назвать реакциями присоединения, так как атомы двух разных веществ объединяются в одно. Примером подобного процесса может служить реакция между калием и хлором, в результате которой образуется хлорид рассматриваемого металла. Для проведения данного взаимодействия необходимо взять два этих компонента - два моля первого и один второго. В результате образуется два моля соединения калия. Эта реакция выражается таким уравнением: 2К + СІ2 = 2КСІ. С азотом калий может давать соединения при горении на открытом воздухе. Во время этой реакции расходуется рассматриваемый металл и азот в молярном соотношении шесть частей к одной, в результате данного взаимодействия образуется нитрид калия в количестве двух частей. Это можно показать в виде следующего уравнения: 6К + N2 = 2K3N. Это соединение представляет собой кристаллы зелено-черного цвета. С фосфором рассматриваемый металл реагирует по такому же принципу. Если взять три моля калия и один моль фосфора, получим один моль фосфида. Данное химическое взаимодействие можно записать в виде такого уравнения реакции: 3К + Р = К3Р. Кроме того, калий способен реагировать с водородом, образуя при этом гидрид. В качестве примера может быть приведено такое уравнение: 2К + Н2 = 2КН. Все реакции присоединения происходят только при наличии высоких температур.
Взаимодействие со сложными веществами
Характеристика калия с точки зрения химии предусматривает рассмотрение и этой темы. К с которыми способен реагировать калий, относятся вода, кислоты, соли, оксиды. Со всеми ними рассматриваемый металл реагирует по-разному.

Калий и вода
Данный химический элемент бурно реагирует с ней. При этом образуется гидроксид, а также водород. Если взять по два моля калия и воды, то получим столько же и один моль водорода. Данное химическое взаимодействие можно выразить с помощью следующего уравнения: 2К + 2Н2О = 2КОН = Н2.
Реакции с кислотами
Так как калий - активный металл, он с легкостью вытесняет атомы гидрогена из их соединений. Примером может быть реакция, которая происходит между рассматриваемым веществом и соляной кислотой. Для ее проведения нужно взять два моля калия, а также кислоту в том же количестве. В результате образуется - два моля и водород - один моль. Этот процесс можно записать таким уравнением: 2К + 2НСІ = 2КСІ + Н2.

Калий и оксиды
С данной группой неорганических веществ рассматриваемый металл реагирует только при значительном нагревании. Если атом металла, входящего в состав оксида, пассивнее того, о котором мы говорим в данной статье, происходит, по сути, реакция обмена. Например, если взять два моля калия и один моль оксида купрума, то в результате их взаимодействия можно получить по одному молю оксида рассматриваемого химического элемента и чистый купрум. Это можно показать в виде такого уравнения: 2К + CuO = К2О + Cu. Вот где проявляются сильные восстановительные свойства калия.
Взаимодействие с основаниями
Калий способен реагировать с гидроксидами металлов, которые находятся правее него в электрохимическом ряду активности. В таком случае также проявляются его восстановительные свойства. Например, если взять два моля калия и один моль гидроксида бария, то в результате реакции замещения мы получим такие вещества, как гидроксид калия в количестве два моля и чистый барий (один моль) - он выпадет в осадок. Представленное химическое взаимодействие можно отобразить в виде следующего уравнения: 2К + Ba(OH)2 = 2КОН + Ba.
Реакции с солями
В данном случае калий все так же проявляет свои свойства как сильный восстановитель. Замещая атомы химически более пассивных элементов, он позволяет получить чистый металл. Например, если добавить к в количестве два моля три моля калия, то в результате данной реакции получим три моля хлорида калия и два моля алюминия. Выразить данный процесс с помощью уравнения можно следующим образом: 3К + 2АІСІ3 = 3КСІ2 + 2АІ.

Реакции с жирами
Если добавить калий к какому-либо органическому веществу данной группы, он также вытеснит один из атомов гидрогена. Например, при смешивании стеарина с рассматриваемым металлом образуется стеарат калия и водород. Полученное вещество применяется для изготовления жидкого мыла. На этом характеристика калия и его взаимодействий с другими веществами заканчивается.
Использование калия и его соединений
Как и все металлы, рассматриваемый в данной статье необходим для многих процессов в промышленности. Основное применение калия происходит в химической отрасли. Благодаря своей высокой химической активности, ярко выраженным щелочнометаллическим и восстановительным свойствам, он применяется в качестве реагента для многих взаимодействий и получения разнообразных веществ. Кроме того, сплавы с содержанием калия используются как теплоносители в ядерных реакторах. Также рассматриваемый в данной статье металл находит свое применение в электротехнике. Помимо всего вышеперечисленного, он является одним из главных компонентов удобрений для растений. Кроме того, его соединения применяются в самых разнообразных отраслях промышленности. Так, в добыче золота используется цианид калия, который служит реагентом для выделения ценных металлов из руд. В производстве стекла применяется Фосфаты рассматриваемого химического элемента являются компонентами всевозможных чистящих средств и порошков. В спичках присутствует хлорат данного металла. В изготовлении пленок для старых фотоаппаратов использовался бромид рассматриваемого элемента. Как вы уже знаете, добыть его возможно путем бромирования калия в условии высокой температуры. В медицине используется хлорид данного химического элемента. В мыловарении - стеарат и другие производные от жиров.
Получение рассматриваемого металла

В наше время калий добывают в лабораториях двумя основными способами. Первый - восстановление его из гидроксида с помощью натрия, который химически еще более активен, чем калий. А второй - получение его из хлорида, тоже с помощью натрия. Если добавить к одному молю гидроксида калия столько же натрия, образуется по одному молю щелочи натрия и чистого калия. Уравнение данной реакции выглядит следующим образом: КОН + Na = NaOH + К. Для проведения реакции второго типа нужно смешать хлорид рассматриваемого металла и натрий в равных молярных пропорциях. В результате этого образуются такие вещества, как кухонная соль и калий в одинаковом соотношении. Выразить данное химическое взаимодействие можно с помощью такого уравнения реакции: КСІ + Na = NaCl + К.
Строение калия
Атом данного химического элемента, как и всех остальных, состоит из ядра, в котором содержатся протоны и нейтроны, а также электронов, которые вращаются вокруг него. Количество электронов всегда равно количеству протонов, которые находятся внутри ядра. Если же какой-либо электрон отсоединился или присоединился к атому, то он уже перестает быть нейтральным и превращается в ион. Они бывают двух видов: катионы и анионы. Первые обладают положительным зарядом, а вторые - отрицательным. Если к атому присоединился электрон, то он превращается в анион, если же какой-либо из электронов покинул свою орбиту, нейтральный атом становится катионом. Так как порядковый номер калия, согласно таблице Менделеева, девятнадцать, то и протонов в ядре данного химического элемента находится столько же. Поэтому можно сделать вывод, что и электронов вокруг ядра расположено девятнадцать. Количество протонов, которые содержатся в структуре атома, можно определить, отняв от атомной массы порядковый номер химического элемента. Так можно сделать вывод, что в ядре калия находится двадцать протонов. Так как рассматриваемый в этой статье металл принадлежит к четвертому периоду, он имеет четыре орбиты, на которых равномерно располагаются электроны, которые все время находятся в движении. Схема калия выглядит следующим образом: на первой орбите расположены два электрона, на второй - восемь; также как и на третьей, на последней, четвертой, орбите вращается всего один электрон. Этим и объясняется высокий уровень химической активности данного металла - его последняя орбита не заполнена полностью, поэтому он стремится соединиться с какими-либо другими атомами, в результате чего их электроны последних орбит станут общими.
Где можно встретить данный элемент в природе?
Так как он обладает чрезвычайно высокой химической активностью, то на планете он нигде не встречается в чистом виде. Его можно увидеть только в составе разнообразных соединений. калия в земной коре составляет 2,4 процента. Самые распространенные минералы, в состав которых входит калий, - это сальвинит и карналлит. Первый обладает следующей химической формулой: NaCl.KCl. Он обладает пестрой расцветкой и состоит из множества кристаллов разнообразной окраски. В зависимости от соотношения хлорида калия и натрия, а также от наличия примесей, он может содержать красные, синие, розовые, оранжевые составляющие. Второй минерал - карналлит - выглядит как прозрачные, нежно-голубые, светло-розовые либо бледно-желтые кристаллы. Его химическая формула выглядит так: KCl.MgCl2.6Н2О. Он является кристаллогидратом.
Роль калия в организме, симптомы недостатка и избытка
Он вместе с натрием поддерживает водно-солевой баланс клетки. Также он участвует в передаче между мембранами нервного импульса. Кроме того, он регулирует кислотно-щелочной баланс в клетке и во всем организме в целом. Он принимает участие в процессах обмена веществ, противодействует возникновению отеков, входит в состав цитоплазмы - около пятидесяти ее процентов - соли рассматриваемого металла. Главными признаками того, что организму не хватает калия, является отечность, возникновение такого заболевания, как водянка, раздражительность и нарушения в работе нервной системы, заторможенность реакции и ухудшение памяти.

Кроме того, недостаточное количество данного микроэлемента отрицательно сказывается на сердечно-сосудистой и мышечной системах. Недостаток калия на протяжении очень длительного времени может спровоцировать инфаркт либо инсульт. А вот из-за избытка калия в организме может развиться язва тонкого кишечника. Для сбалансирования своего питания таким образом, чтобы получать нормальное количество калия, нужно знать, в каких продуктах он содержится.
Еда с высоким содержанием рассматриваемого микроэлемента
Прежде всего, это орехи, такие как кешью, грецкие, фундук, арахис, миндаль. Также большое его количество находится в картошке. Кроме того, калий содержится в сухофруктах, таких как изюм, курага, чернослив. Данным элементом богаты и кедровые орешки. Также высокая его концентрация наблюдается в бобовых: фасоли, горохе, чечевице. Морская капуста также богата данным химическим элементом. Еще одними продуктами, содержащими данный элемент в большом количестве, являются зеленый чай и какао. Кроме того, в высокой концентрации он находится и во многих фруктах, таких как авокадо, бананы, персики, апельсины, грейпфруты, яблоки. Многие крупы богаты рассматриваемым микроэлементом. Это прежде всего перловка, а также пшеничная и гречневая крупа. В петрушке и брюссельской капусте тоже есть много калия. Кроме того, он содержится в моркови и дыне. Лук и чеснок обладают немалым количеством рассматриваемого химического элемента. Куриные яйца, молоко и сыр также отличаются высоким содержанием в них калия. Суточная норма данного химического элемента для среднестатистического человека составляет от трех до пяти граммов.
Заключение
Прочитав эту статью, можно сделать вывод, что калий является чрезвычайно важным химическим элементом. Он необходим для синтезирования многих соединений в химической промышленности. Кроме того, используется и во многих других отраслях. Также он очень важен для организма человека, поэтому должен регулярно и в необходимом количестве поступать туда с едой.
Ка́лий - элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов , с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) - мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K 2 SO 4 , соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали - поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента - K.
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600-650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде - хлор:
K + + e - → K
2Cl - − 2e - → Cl 2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде - кислород:
4OH - − 4e - → 2H 2 O + O 2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства
Калий - серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Калий был открыт осенью 1807 года английским химиком Дэви при электролизе твёрдого едкого кали. Увлажнив едкий кали, ученый выделил металл, которому дал название потассий, намекая на производство поташа (необходимого ингредиента для изготовления моющих средств) из золы. Своё привычное название металл получил через два года, в 1809г, инициатором переименования вещества стал Л.В. Гильберт, предложивший название калий (от арабского аль-кали - поташ).
Калий (лат. Kalium) является мягким щелочным металлом, элементом главной подгруппы I группы, IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 19 и обозначение - К .
Нахождение в природе
Калий в свободном состоянии в природе не встречается, он входит в состав всех клеток. Достаточно распространённый металл, занимает 7-е место по содержанию в земной коре (calorizator). Основными поставщиками калия являются Канада, Белоруссия и Россия, имеющие крупные месторождения данного вещества.
Физические и химические свойства
Калий - легкоплавкий металл серебристо-белого цвета. Имеет свойство окрашивать открытый огонь в яркий фиолетово-розовый цвет.
Калий имеет высокую химическую активность, это сильный восстановитель. При реакции с водой происходит взрыв, при длительном нахождении на воздухе полностью разрушается. Поэтому калий требует определённых условий для хранения - его заливают слоем керосина, силикона или бензина, для исключения вредных для металла контактов с водой и атмосферой.
Основными пищевыми источниками калия являются сушёные , , ореховое масло, цитрусовые, все зелёные овощи с листьями, . Калия достаточно много в рыбе и . Вообще, калий входит в состав почти всех растений. и - чемпионы по содержанию калия.

Суточная потребность в калии
Суточная потребность организма человека в калии зависит от возраста, физического состояния и даже места проживания. Взрослым здоровым людям нужно 2,5г калия, беременным женщинам - 3,5г, спортсменам - до 5-ти грамм калия ежедневно. Количество необходимого калия для подростков рассчитывается по весу - 20 мг калия на 1 кг массы тела.
Полезные свойства калия и его влияние на организм
Калий участвует в процессе проведения нервных импульсов и передачи их на иннервируемые органы. Способствует лучшей деятельности головного мозга, улучшая снабжение его . Оказывает положительное влияние при многих аллергических состояниях. Калий необходим для осуществления сокращений скелетных мышц. Калий регулирует содержание в организме солей, щелочей и кислот, чем способствует уменьшению отёков.
Калий содержится во всех внутриклеточных жидкостях, он необходим для нормальной жизнедеятельности мягких тканей (мышц, сосудов и капилляров, желез внутренней секреции и т.д.)
Усвояемость калия
Калий всасывается в организм из кишечника, куда поступает с пищей, выводится с мочой обычно в таком же количестве. Излишний калий выводится из организма тем же путём, не задерживается и не накапливается. Препятствиями для нормального всасывания калия могут послужить чрезмерное употребление кофе, сахара, алкоголя.
Взаимодействие с другими
Калий работает в тесном контакте с натрием и магнием, при росте концентрации калия из организма стремительно выводится натрий, а уменьшение количества магния может нарушить усвоение калия.

Признаки нехватки калия
Нехватка калия в организме характеризуется мышечной слабостью, быстрой утомляемостью, снижением иммунитета, сбоями в работе миокарда, нарушениями показателей артериального давления, учащённым и затруднённым дыханием. Кожные покровы могут шелушиться, повреждения плохо заживают, волосы становятся очень сухими и ломкими. Происходят сбои в работе желудочно-кишечного тракта - тошнота, рвота, расстройства желудка вплоть до гастрита и язвы.
Признаки избытка калия
Переизбыток калия наступает при передозировке препаратов, содержащих калий и характеризуется нервно-мышечными расстройствами, повышенной потливостью, возбудимостью, раздражительностью и плаксивостью. Человек постоянно испытывает чувство жажды, которое приводит к частым мочеиспусканиям. Желудочно-кишечный тракт реагирует кишечными коликами, чередованием запоров и поносов.
Применение калия в жизни
Калий в виде основных соединений находит широкое применение в медицине, сельском хозяйстве и промышленности. Калийные удобрения необходимы для нормального роста и вызревания растений, а всем известная марганцовка , это не что иное, как перманганат калия, испытанный временем антисептик.
Человечество знакомо с калием больше полутора веков. В лекции, прочитанной в Лондоне 20 ноября 1807 г. Хэмфри Дэви сообщил, что при электролизе едкого калия он получил «маленькие шарики с сильным металлическим блеском... Некоторые из них сейчас же после своего образования сгорали со взрывом». Это и был калий .
Калий - замечательный металл . Замечателен он не только потому, что режется ножом, плавает в воде, вспыхивает на ней со взрывом и горит, окрашивая пламя в фиолетовый цвет. И не только потому, что этот элемент - один из самых активных химически. Все это можно считать естественным, потому что соответствует положению щелочного металла калия в таблице Менделеева. Калий замечателен своей незаменимостью для всего живого и примечателен как всесторонне «нечетный» металл.
Обратите внимание: его атомный номер 19, атомная масса 39, во внешнем электронном слое - один электрон, валентность 1+ . Как считают химики, именно этим объясняется исключительная подвижность калия в природе. Он входит в состав нескольких сотен минералов . Он находится в почве, в растениях, в организмах людей и животных. Он - как классический Фигаро: здесь - там - повсюду.
Калий и почва
Вряд ли можно объяснить случайностью или прихотью лингвистов тот факт, что в русском языке одним словом обозначаются и сама наша планета, и ее верхний слой - почва. «Земля-матушка», «земля-кормилица» - это, скорее, о почве, чем о планете в целом...
Но что такое почва? Самостоятельное и весьма своеобразное природное тело. Оно образуется из поверхностных слоев разнообразных горных пород под действием воздуха, воды, температурных перепадов, жизнедеятельности всевозможных обитателей Земли. Ниже, под почвой, скрыты так называемые материнские горные породы, сложенные из различных минералов. Они постепенно разрушаются и пополняют «запасы» почвы. А в почве, помимо чисто механического, постоянно происходит и другое разрушение. Его называют химическим выветриванием. Вода и углекислый газ (в меньшей мере другие вещества) постепенно разрушают минералы.
Почти 18% веса земной коры приходится на долю калийсодержащего минерала - ортоклаза . Это двойная соль кремневой кислоты K 2 Al 2 Si 6 O 16 или K 2 O-Al 2 O 3 -BSiO 2 . Вот что происходит с ортоклазом в результате химического выветривания:
K 2 O*AI 2 O 3 *6SO 2 + 2Н 2 О + CO 2 → K 2 CO 3 + Al 2 O 3 *2SO 2 *2H 2 O + + 4SiO 2 .
Ортоклаз превращается в каолин (разновидность глины), песок и поташ. Песок и глина идут на построение минерального костяка почвы, а K, перешедший из ортоклаза в поташ, «раскрепощается», становится доступным для растений. Но не весь сразу.
В почвенных водах молекулы K 2 CO 3 диссоциируют: К 2 СO 3 ↔ + К + + КСO 3 - ↔ 2К + + CO 3 2- . Часть ионов калия остается в почвенном растворе, который для растений служит источником питания. Но большая часть ионов калия поглощается коллоидными частицами почвы, откуда корням растений извлечь их довольно трудно. Вот и получается, что, хотя калия в земле много, часто растениям его не хватает. Из-за того, что комочки почвы «запирают» большую часть калия, содержание этого элемента в морской воде почти в 50 раз меньше, чем натрия. Подсчитано, что из тысячи атомов калия, освобождающихся при химическом выветривании, только два достигают морских бассейнов, а 998 остаются в почве. «Почва поглощает калий, и в этом ее чудодейственная сила», - писал академик А. Е. Ферсман.
Калий и растения
Калий содержится во всех растениях . Отсутствие калия приводит растение к гибели. Почти весь калий находится в растениях в ионной форме - K + . Часть ионов находится в клеточном соке, другая часть поглощена структурными элементами клетки. Ионы калия участвуют во многих биохимических процессах, происходящих в растении. Установлено, что в клетках растений эти ионы находятся главным образом в протоплазме. В клеточном ядре они не обнаружены. Следовательно, в процессах размножения и в передаче наследственных признаков элемент № 19 не участвует. Но и без этого роль калия в жизни растения велика и многообразна.
Калий входит и в плоды, и в корни, и в стебли, и в листья, причем в вегетативных органах его, как правило, больше, чем в плодах. Еще одна характерная особенность: в молодых растениях больше калия, чем в старых. Замечено также, что по мере старения отдельных органов растений ионы калия перемещаются в точки наиболее интенсивного роста. При недостатке калия растения медленнее растут, их листья, особенно старые, желтеют и буреют по краям, стебель становится тонким и непрочным, а семена теряют всхожесть.
Установлено, что ионы калия активизируют синтез органических веществ в растительных клетках. Особенно сильно влияют они на процессы образования углеводов. Если калия не хватает, растение хуже усваивает углекислый газ, и для синтеза новых молекул углеводов ему недостает углеродного «сырья». Одновременно усиливаются процессы дыхания, и сахара, содержащиеся в клеточном соке, окисляются. Таким образом, запасы углеводов в растениях, оказавшихся на голодном пайке (по калию), не пополняются, а расходуются. Плоды такого растения - это особенно заметно на фруктах - будут менее сладкими, чем у растений, получивших нормальную дозу калия. Крахмал - тоже углевод, поэтому и на его содержание в плодах сильно влияет элемент № 19.
Но и это не все. Растения, получившие достаточно калия, легче переносят засуху и морозные зимы. Это объясняется тем, что элемент № 19 влияет на способность коллоидных веществ растительных клеток поглощать воду и набухать. Не хватает калия - клетки хуже усваивают и удерживают влагу, сжимаются, отмирают.
Ионы калия влияют и на азотный обмен веществ. При недостатке калия в клетках накапливается избыток аммиака. Это может привести к отравлению и гибели растения.
Уже упоминалось, что K влияет и на дыхание растений, а усиление дыхания сказывается не только на содержании углеводов. Чем интенсивнее дыхание, тем активнее идут все окислительные процессы, и многие органические вещества превращаются в органические кислоты. Избыток кислот может вызвать распад белков. Продукты этого распада - весьма благоприятная среда для грибков и бактерий. Вот почему при калийном голодании растения намного чаще поражаются болезнями и вредителями. Фрукты и овощи, содержащие продукты распада белков, плохо переносят транспортировку, их нельзя долго хранить.Одним словом, хочешь получать вкусные и хорошо сохраняющиеся плоды - корми растение калием вволю. А для зерновых калий важен еще по одной причине: он увеличивает прочность соломы и тем самым предупреждает полегание хлебов...
- ВСТРЕЧА С КАЛИЕМ? Если на складе или на товарной станции вы увидите стальные ящики с надписями: «Огнеопасно!», «От воды взрывается», то весьма вероятно, что вы встретились с калием.
Много предосторожностей предпринимают при перевозке этого металла. Поэтому, вскрыв стальной ящик, вы не увидите калия, а увидите тщательно запаянные стальные банки. В них - калий и инертный газ - единственная безопасная для калия среда. Большие партии калия перевозят в герметических контейнерах под давлением инертного газа, равным 1,5 атм.
- ЗАЧЕМ НУЖЕН МЕТАЛЛИЧЕСКИЙ КАЛИЙ? Металлический K используют как катализатор в производстве некоторых видов синтетического каучука, а также в лабораторной практике. В последнее время основным применением этого металла стало производство перекиси калия K 2 O 2 , используемой для регенерации кислорода . Сплав калия с натрием служит теплоносителем в атомных реакторах, а в производстве титана - восстановителем.
- ИЗ СОЛИ И ЩЕЛОЧИ. Получают элемент №19 чаще всего в обменной реакции расплавленных едкого калия и металлического натрия: KOH + Na → NaOH + K. Процесс идет в ректификационной колонне из никеля при температуре 380-440°С. Подобным образом получают элемент № 19 и из хлористого калия, только в этом случае температура процесса выше - 760-800°С. При такой температуре и натрий, и калий превращаются в пар, а хлористый калий (с добавками) плавится. Пары натрия пропускают через расплавленную соль и конденсируют полученные пары калия. Этим же способом получают и сплавы натрия с калием. Состав сплава в большой мере зависит от условий процесса.
- КАК БЫТЬ, ЕСЛИ вы впервые имеете дело с металлическим калием. Необходимо помнить о высочайшей реакционной способности этого металла, о том, что калий воспламеняется от малейших следов воды. Работать с калием обязательно в резиновых перчатках и защитных очках, а лучше - в маске» закрывающей все лицо. С большими количествами калия работают в специальных камерах, заполненных азотом или аргоном. (Разумеется, в специальных скафандрах.) А если K все-таки воспламенился, его тушат не водой, а содой или поваренной солью.
- КАК БЫТЬ С ОТХОДАМИ. Правила безопасности категорически запрещают накапливать в лабораториях больше двух граммов остатков или отходов какого-либо щелочного металла, калия в том числе. Отходы подлежат уничтожению на месте. Классический способ - образование под действием этилового спирта этилата калия C 2 H 5 OK: просто льют в отходы спирт. Но есть и другой - безспиртовой способ. Отходы заливают керосином или бензином. Калий с ними не реагирует и, будучи легче воды, но тяжелее этих органических жидкостей, оседает на дно. И тогда в наклоненный сосуд начинают по каплям добавлять воду. Когда вода доберется до металла, произойдет реакция и K превратится в едкое кали. Слои щелочного раствора и керосина или бензина довольно легко разделяются на делительной воронке.
- ЕСТЬ ЛИ В РАСТВОРЕ ИОНЫ КАЛИЯ? Выяснить это несложно. Проволочное колечко опустите в раствор, а затем внесите в пламя газовой горелки. Если калий есть, пламя окрасится в фиолетовый цвет, правда, не в такой яркий, как желтый цвет, придаваемый пламени соединениями натрия. Сложнее определить, сколько калия в растворе. Нерастворимых в воде соединений у этого металла немного. Обычно калий осаждают в виде перхлората - соли очень сильной хлорной кислоты HClO 4 . Кстати, перхлорат калия - очень сильный окислитель и в этом качестве применяется в производстве некоторых взрывчатых веществ и ракетных топлив.
- ДЛЯ ЧЕГО НУЖЕН ЦИАНИСТЫЙ КАЛИЙ? Для извлечения золота и серебра из руд. Для гальванического золочения и серебрения неблагородных металлов. Для получения многих органических веществ. Для азотирования стали - это придает ее поверхности большую прочность. К сожалению, это очень нужное вещество чрезвычайно ядовито. А выглядит KCN вполне безобидно: мелкие кристаллы белого цвета с коричневатым или серым оттенком.
- ЧТО ТАКОЕ ХРОМПИК? Точнее - хромпик калиевый. Это оранжевые кристаллы состава K 2 Cr 2 O 7 . Хромпик используют в производстве красителей, а его растворы - для «хромового» дубления кож, а также в качестве протравы при окраске и печатании тканей. Раствор хромпика в серной кислоте - хромовая смесь, которую во всех лабораториях применяют для мытья стеклянной посуды.
- ЗАЧЕМ НУЖНО ЕДКОЕ КАЛИ? В самом деле, зачем? Ведь свойства этой щелочи и более дешевого едкого натра практически одинаковы. Разницу между этими веществами химики обнаружили лишь в XVIII в. Самое заметное различие между NaOH и KOH в том, что едкое кали в воде растворяется еще лучше, чем едкий натр. KOH получают электролизом растворов хлористого калия. Чтобы примесь хлоридов была минимальной, используют ртутные катоды. А нужно это вещество прежде всего как исходный продукт для получения различных солей калия. Кроме того, без едкого кали не обойтись в производстве жидких мыл, некоторых красителей и органических соединений. Раствор едкого кали используется в качестве электролита в щелочных аккумуляторах.
- СЕЛИТРА ИЛИ СЕЛИТРЫ? Правильнее - селитры. Это общее название азотнокислых солей щелочных и щелочноземельных металлов. Если же говорят просто «селитра» (не «натриевая» или «кальциевая» или «аммиачная», а просто - «селитра»), то имеют в виду нитрат калия. Этим веществом человечество пользуется уже больше тысячи лет - для получения черного пороха. Кроме того, селитра - первое двойное удобрение: из трех важнейших для растений элементов в ней есть два - азот и калий. Вот как описал селитру Д. И. Менделеев в «Основах химии»:
«Селитра представляет бесцветную соль, имеющую особый прохладительный вкус. Она легко кристаллизуется длинными, по бокам бороздчатыми, ромбическими, шестигранными призмами, оканчивающимися такими же пирамидами. Ее кристаллы (уд. вес 1,93) не содержат воды. При слабом накаливании (339°) селитра плавится в совершенно бесцветную жидкость. При обыкновенной температуре в твердом виде KNO 3 малодеятельна и неизменна, но при возвышенной температуре она действует как весьма сильное окисляющее средство, потому что может отдать смешанным с нею веществам значительное количество кислорода. Брошенная на раскаленный уголь селитра производит быстрое его горение, а механическая смесь ее с измельченным углем загорается от прикосновения с накаленным телом и продолжает сама собою гореть. При этом выделяется азот, а кислород селитры идет на окисление угля, вследствие чего и получаются углекалиевая соль и углекислый газ...
В химической практике и технике селитра употребляется во многих случаях как окислительное сродство, действующее при высокой температуре. На этом же основано применение ее для обыкновенного пороха, который есть механическая смесь мелко измельченных: серы, селитры и угля».
- ГДЕ И ДЛЯ ЧЕГО ПРИМЕНЯЮТСЯ ПРОЧИЕ СОЛИ КАЛИЯ? Бромистый калий KBr - в фотографии, чтобы предохранить негатив или отпечаток от вуали.
- Йодистый калий KI - в медицине и как химический реактив.
- Фтористый калий KF - в составе металлургических флюсов и для введения фтора в органические соединения.
- Углекислый калий (поташ) K 2 CO 3 - в стекольном и мыловаренном производствах, а также как удобрение.
- Фосфаты калия, в частности K 4 P 2 O 7 и K 5 P 3 O 10 , - как компоненты моющих средств.
- Хлорат калия (бертолетова соль) KClO 3 - в спичечном производстве и пиротехнике.
- Кремнефтористый калий K 2 SiF 6 - как добавка к шихте при извлечении редкоземельных элементов из минералов.
- Железистосинеродистый калий (желтая кровяная соль) K 4 Fe(CN) 6 -SH 2 O - как протрава при крашении тканей и в фотографии.
- ПОЧЕМУ КАЛИЙ НАЗВАЛИ КАЛИЕМ? Слово это арабского происхождения. По-арабски, «аль-кали» - зола растений. Впервые калий получен из едкого кали, а едкое кали - из поташа, выделенного из золы растений... Впрочем, в английском и других европейских языках сохранилось название potassium, данное калию его первооткрывателем X. Дэви. В русскую химическую номенклатуру название «калий» введено в 1831 г. Г. И. Гессом.
- ОТНЮДЬ HE ТОЛЬКО В КУРАГЕ. Сердечникам, в первую очередь людям, перенесшим инфаркт, для восполнения потерь калия в организме настоятельно рекомендуют есть курагу. Или в крайнем случае изюм. В 100 граммах кураги до 2 г калия. Столько же ее в урюке (но для точности при расчете надо вычесть вес косточек). Изюм содержит калия примерно вдвое меньше. Но не надо думать, будто сухофрукты - единственный источник калия. Его довольно много почти в любой растительной пище. Например, сорок граммов жареного картофеля эквивалентны 10 граммам отборной кураги. Богаты калием бобовые, чай, порошок какао. Одним словом, суточную дозу калия (2,5-5 г) при нормальном питании получить нетрудно.
Популярное
- Значение китайско-тибетские языки в лингвистическом энциклопедическом словаре
- Расцвет испании и начало ее упадка
- Толкование сна сплетни в сонниках Приснилось что обо мне сплетничают
- К чему снится покойный муж?
- Гадаем дома: как гадать на чае Гадание на чайной гуще значение
- STEM -образование детей дошкольного и младшего школьного возраста Stem образование на уроках информатики
- Минералого-петрографическое описание шлифов Схема петрографического описания
- Achilles — британская ПТ-САУ VI уровня
- Боевые Реактивные Самолёты (журнал)
- Комикс эрже про приключения тинтина